在2024年11月,《Cancer Cell》期刊上發(fā)表了一篇題為“Long-term Breast Cancer Response to CDK4/6 Inhibition Defined by TP53-Mediated Geroconversion”的研究文章��。該研究深入探討了TP53基因狀態(tài)對HR+(激素受體陽性)乳腺癌患者接受CDK4/6抑制劑治療響應的影響。研究揭示了一個重要發(fā)現(xiàn):在p53缺失導致耐藥性的情況下�����,通過聯(lián)合抑制CDK2可以克服這一難題�����,從而實現(xiàn)長期疾病控制的新機制��。這一發(fā)現(xiàn)為開發(fā)新的聯(lián)合治療方案提供了堅實的理論基礎(chǔ)�,并有望顯著改善患者的治療預后���。

(文章標題截圖)
研究背景
乳腺癌是全球女性中最常見的惡性腫瘤類型之一����,其中激素受體陽性(HR+)乳腺癌占據(jù)了顯著的比例。CDK4/6抑制劑作為HR+乳腺癌治療領(lǐng)域的重要藥物�����,通過作用于細胞周期G1期的關(guān)鍵蛋白���,有效減緩了疾病的進展。然而�����,患者對CDK4/6抑制劑的治療響應卻表現(xiàn)出極大的差異性��,有的患者僅能維持幾個月的療效�,而有的患者則能持續(xù)受益數(shù)年之久��。
研究設(shè)計
本研究是一項基于大規(guī)模、具有詳細臨床注釋的隊列研究����,納入了共計467名接受一線CDK4/6抑制劑(具體為阿貝西利����、帕博西利和哌柏西利)聯(lián)合內(nèi)分泌療法的轉(zhuǎn)移性HR+乳腺癌患者����。研究團隊利用MSK-IMPACT這一先進的檢測平臺��,對患者的腫瘤樣本進行了深入的基因組測序�,旨在探究與治療響應密切相關(guān)的基因變異��。
根據(jù)患者對治療的不同響應時長�����,研究將患者劃分為短期���、中期和長期響應三個組別。隨后���,采用Firth懲罰邏輯回歸分析和彈性網(wǎng)Cox回歸模型�����,系統(tǒng)地分析了這些基因變異與無進展生存期(PFS)之間的潛在關(guān)聯(lián),以期揭示影響CDK4/6抑制劑療效的關(guān)鍵因素�。
研究結(jié)果
研究揭示�,TP53基因的缺失(占比27.6%)和MDM2基因的擴增(占比6.4%)與HR+乳腺癌患者缺乏長期疾病控制顯著相關(guān)。在HR+乳腺癌的模型中����,p53的缺失并未直接影響CDK4/6的活性或G1期的阻滯,而是通過激活CDK2���,促進了藥物不敏感的p130磷酸化過程�。這種磷酸化的p130持續(xù)存在�����,有效阻止了DREAM復合體的正常組裝��,從而使得細胞能夠逃逸原有的生長阻滯��,重新進入細胞周期,進而促進了腫瘤的進展��。
值得注意的是,CDK2抑制劑的引入能夠克服p53缺失所帶來的不利影響����,誘導細胞發(fā)生衰老轉(zhuǎn)化,并展現(xiàn)出明顯的衰老表型�。這一發(fā)現(xiàn)表明,要實現(xiàn)HR+乳腺癌的長期治療響應�,完全抑制CDK4/6和CDK2激酶活性似乎是不可或缺的條件��。
1����、TP53和MDM2基因變異與長期疾病控制的關(guān)聯(lián)
本研究首先針對467名接受一線CDK4/6抑制劑治療的轉(zhuǎn)移性HR+乳腺癌患者進行了深入分析�����,結(jié)果揭示出TP53基因的缺失(占比達到27.6%)以及MDM2基因的擴增(占比6.4%)與患者缺乏長期疾病控制之間存在顯著關(guān)聯(lián)����。這一重要發(fā)現(xiàn)提示我們,TP53和MDM2的基因狀態(tài)或許能夠作為預測CDK4/6抑制劑治療效果的關(guān)鍵生物標志物�����。
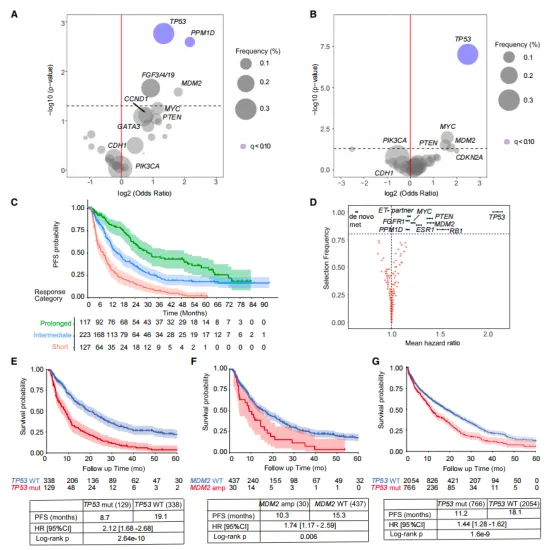
(圖1 在未能實現(xiàn)長期對CDK4/6i反應的患者中富集的體細胞變化)
2、TP53缺失對CDK4/6抑制劑反應的影響
研究進一步借助HR+乳腺癌模型�,深入探索了p53缺失對CDK4/6抑制劑療效的具體影響機制。結(jié)果表明����,p53的缺失并未直接改變CDK4/6的活性或阻礙G1期的阻滯作用����,而是通過激活CDK2,促進了藥物不敏感的p130蛋白的磷酸化過程����。這種磷酸化的p130蛋白持續(xù)存在�,有效地阻止了DREAM復合體的正常組裝�,進而使得細胞能夠擺脫生長抑制,重新進入細胞周期���,加速了腫瘤的惡性進展�����。
3�����、CDK2抑制劑的潛在治療作用
研究中還取得了另一項重要發(fā)現(xiàn):CDK2抑制劑展現(xiàn)出了克服p53缺失所引發(fā)的耐藥性的能力���。它通過促進細胞發(fā)生衰老轉(zhuǎn)化(即geroconversion)��,并誘導出衰老表型的顯現(xiàn)�,從而實現(xiàn)了對腫瘤生長的長期抑制效果。這一發(fā)現(xiàn)強烈暗示�,聯(lián)合抑制CDK4/6和CDK2或許能夠成為一種針對TP53突變型HR+乳腺癌的有效治療手段,同時也有助于抑制藥物耐受性的發(fā)展�,為這類患者的治療提供了新的潛在策略����。
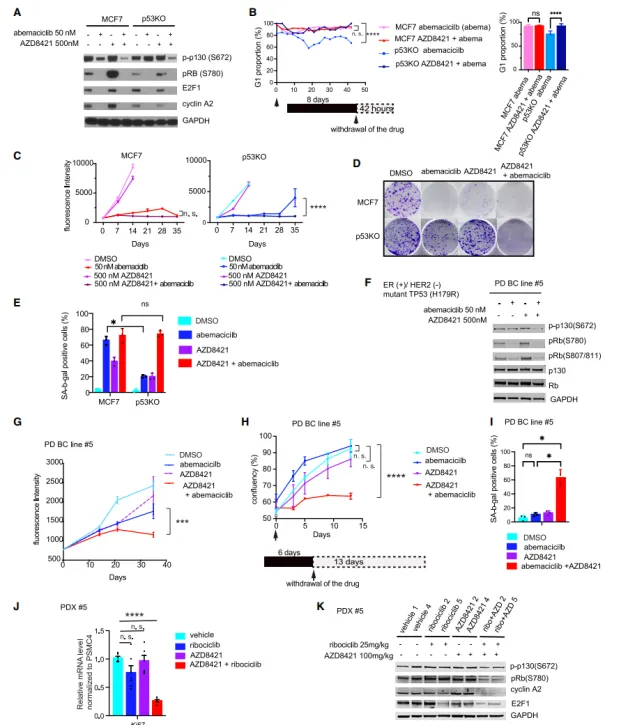
(圖2 CDK2和CDK4/6的聯(lián)合抑制實現(xiàn)持久的腫瘤生長抑制)
4��、長期反應與基因組多樣性的相關(guān)性
研究結(jié)果進一步強調(diào)����,為了在具有基因組多樣性的HR+乳腺癌患者中實現(xiàn)持久的治療反應,完全抑制CDK4/6和CDK2激酶的活動似乎是至關(guān)重要的��。這一點在圖1中得到了直觀的體現(xiàn)��,該圖詳細展示了不同基因變異狀態(tài)與長期疾病控制之間的密切關(guān)聯(lián)����,并且通過彈性網(wǎng)Cox回歸模型對患者進行了風險分組�����,進一步揭示了不同基因型患者對于治療的反應差異及潛在的風險水平���。這些發(fā)現(xiàn)為制定更加精準和有效的治療方案提供了重要的科學依據(jù)。
5��、FELINE試驗中TP53狀態(tài)對治療反應的影響
在對FELINE 2期臨床試驗數(shù)據(jù)的深入分析中���,研究人員觀察到,那些TP53功能喪失的患者在接受CDK4/6抑制劑治療后��,難以實現(xiàn)持久的細胞周期停滯狀態(tài);相比之下��,TP53野生型的患者則能夠維持較低的細胞增殖活性���。這一觀察結(jié)果不僅與先前的研究發(fā)現(xiàn)相吻合,而且進一步強化了TP53狀態(tài)在決定CDK4/6抑制劑治療效果中的關(guān)鍵作用�����,為臨床上根據(jù)TP53狀態(tài)來優(yōu)化患者治療方案提供了有力的證據(jù)支持����。
研究小結(jié)
綜上所述�����,本研究的結(jié)論著重強調(diào)了TP53基因狀態(tài)在預測CDK4/6抑制劑長期療效中的關(guān)鍵作用�����,并創(chuàng)新性地提出了聯(lián)合應用CDK2抑制劑作為一種潛在的治療策略�����,旨在增強p53缺失的HR+乳腺癌患者的治療效果。這一突破性發(fā)現(xiàn)不僅為HR+乳腺癌的個體化治療增添了新的分子標志物��,也為開發(fā)新型聯(lián)合治療方案奠定了堅實的理論基礎(chǔ)���。未來,我們期待通過進一步的研究來驗證這些重要發(fā)現(xiàn)�����,并積極探索如何將這些前沿知識轉(zhuǎn)化為臨床實踐中的精準治療策略����。
通過這項深入細致的研究����,我們不僅深化了對HR+乳腺癌治療響應異質(zhì)性的認識�����,還為未來的治療開辟了新的視野���。隨著精準醫(yī)療領(lǐng)域的不斷發(fā)展和進步��,我們有理由相信�����,為每一位乳腺癌患者提供更加個性化�、更加高效的治療方案將成為可能,從而極大地改善患者的生活質(zhì)量���,延長生存期���。
參考文獻
1���、Kudo R, Safonov A, Jones C, et al. Long-term breast cancer response to CDK4/6 inhibition defined by TP53-mediated geroconversion. Cancer Cell. 2024 Nov 11;42(11):1919-1935.e9. Cancer Cell. 2024 Nov 11;42(11):1983. DOI: 10.1016/j.ccell.2024.10.013.